4.7.5. Aplicaciones de electroquímica en electrónica. y 4.7.6. nanoquímica (propiedades fisicoquímicas no convencionales de polímeros, catenanos y rotaxanos)
integrantes del equipo
Gilberto Henandez Hernandez
Alexis Pluma Juarez
Miguel Angel Diaz Melgar
Gilberto Henandez Hernandez
Alexis Pluma Juarez
Miguel Angel Diaz Melgar
4.7.5. Aplicaciones de electroquímica en electrónica.
Electroquímica
Definición: Electroquímica es una rama de la química que estudia la transformación entre la energía eléctrica y la energía química
En general, la electroquímica se encarga de estudiar las situaciones donde se dan reacciones de oxidación y reducción encontrándose separadas, físicamente o temporalmente, se encuentran en un entorno conectado a un circuito eléctrico
¿Cómo se crea la electricidad?
Existen 5 formas conocidas de crear o producir electricidad los cuales son por fricción, luz, magnetismo, presión y reacciones químicas
El comportamiento de la electricidad está enfocada a los principios de química y física
La electricidad es un fenómeno físico que se basa en el movimiento de electrones libre atravez de un conductor
Aplicaciones de electroquímica en electrónica
Es el dispositivo utilizado para la descomposición mediante corriente eléctrica de sustancias ionizadas denominadas electrolitos.
También se conoce como celda galvánica o voltaica, en honor de los científicos Luigi Galvani y Alessandro Volta
Una batería es un dispositivo electroquímico el cual almacena
Energía en forma química. Cuando se conecta a un circuito
Eléctrico, la energía química se transforma en energía eléctrica.
Batería
Todas las baterías son similares en su construcción y están compuestas por un número de celdas electroquímicas.
Cada una de estas celdas está compuesta de un electrodo positivo y otro negativo además de un separador.
Cuando la batería se está descargando un cambio electroquímico se está produciendo entre los diferentes materiales en los dos electrodos.
Los electrones son transportados entre el electrodo positivo y negativo vía un circuito externo (bombillas, motores de arranque etc.
Celdas electroquimicas
Las celdas electroquímicas tienen dos electrodos: El Ánodo y el Cátodo. El ánodo se define como el electrodo en el que se lleva a cabo la oxidación y el cátodo donde se efectúa la reducción. Los electrodos pueden ser de cualquier material que sea un conductor eléctrico, como metales, semiconductores
Los cationes disueltos se mueven hacia el Cátodo y los aniones hacia el Ánodo. La corriente eléctrica fluye del ánodo al cátodo por que existe una diferencia de potencial eléctrico entre ambos electrolitos. Esa diferencia se mide con la ayuda de un voltímetro y es conocida como el voltaje de la celda. También se denomina fuerza electromotriz (fem) o bien como potencial de celda
Ejemplo
La notación convencional para representar las celdas electroquímicas es un diagrama de celda. En condiciones normales, para la pila de Daniell el diagrama sería:
Zn(s)/Zn2+ (ac)//Cu2+(ac)/Cu(s)
Este diagrama esta definido por: ánodo --> cátodo Electrodo negativo/electrolito // Electrolito/electrodo positivo (el / indica flujo de electrones y el // significa puente salino)
4.7.6. nanoquímica (propiedades fisicoquímicas no convencionales de polímeros, catenanos y rotaxanos)
Nanoquimica
La nanoquímica es una especialidad que se deriva de la nanotecnología y que se encarga del estudio de los grupos de moléculas o átomos aun nivel donde se toman en cuenta las interacciones de manera individual y donde los resultados cuánticos pueden ser significativos, permitiendo la formación de nuevas reacciones químicas
Catenanos
La palabra catenano deriva de la palabra latina catena que significa en cadena.
Los catenanos son estructuras formadas por la interconexión de dos o más macro ciclos para formar una especie de cadena, con cada macro ciclo tomando el papel de un eslabón.
Nomenclatura
Usando esta nomenclatura un 2-catenano tiene dos anillos entrelazados y un 3-catenano, tiene tres. En 1994 un catenano fue reportado poco después de los juegos olímpicos de Lillehammer, este 5-catenano fue llamado olimpiadano por el parecido al símbolo usado en los juegos olímpicos.
Síntesis
Existen dos enfoques principales para la síntesis orgánica de catenanos.
La primera es realizar simplemente una reacción de cierre de anillo con la esperanza de que algunos de los anillos se formen alrededor de otros anillos dando como producto el deseado catenano. Este llamado "enfoque estadístico" condujo a la primera síntesis exitosa de un catenano, sin embargo, el método es altamente ineficiente, originando una alta dilución del anillo que cierra la estructura (bajo rendimiento[3]) y un gran exceso de anillos pre-formados, y por ello rara vez se utiliza.
El segundo enfoque se basa en la organización supramolecular previa de los precursores macrocíclicos, empleando enlaces de hidrógeno, coordinación en torno a centro metálico, fuerzas hidrofóbicas, o interacciones culombianas. Estas interacciones no-covalentes compensan una parte del costo entrópico de la asociación, y ayudan a posicionar los componentes en el último cierre de anillo para formar el catenano deseado. Este enfoque de "síntesis dirigida por plantillas moleculares",[4]Sanders ha demostrado que los enfoques dinámicos utilizando la química combinatoria reversible puede ser particularmente exitosos en la preparación de nuevos catenanos de estructura imprevisible
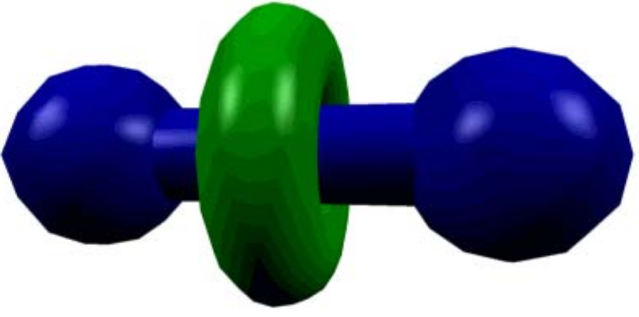
Rotaxonos
Los rotaxanos son estructuras con una molécula en forma de mancuerna rodeada en el centro por un macro ciclo.
Entre las principales ejemplos de la aplicación de esta nueva disciplina podemos encontrar el rotaxano. Estamos hablando de una molécula diminuta con forma de mancuerna capaz de actuar como un interruptor molecular, es decir, a grandes rasgos, de una molécula que es capaz de activar o desactivar determinados componentes celulares nuestros y , en consecuencia, iniciar o frenar una función o efecto
Historia
Los primeros catenanos y rotaxanos fueron sintetizados en la década de 1960, pero no fue sino hasta hace unos años que se empezaron a considerar estas estructuras como posibles fuentes de una aplicación importante.
Al principio, la síntesis de este tipo de estructuras era muy difícil ya que se utilizaban únicamente fuerzas intermoleculares e interacciones ácido-base para dirigir la reacción.
Sin embargo, en la actualidad ya no existe ese tipo de impedimentos ya que se han diseñado métodos de síntesis que incorporan metales de transición para dirigir la reacción.
Ejemplo
Uno de los metales más empleados para esto es el cobre en estado de oxidación (I).
Las estrategias más comunes consisten en formar un complejo con fragmentos coordinantes a cíclicos para luego cerrar los fragmentos mediante una reacción de sustitución u otro tipo de reacción.
El centro metálico puede ser removido posteriormente formando una salinsoluble con otro ligante para obtener el catenano libre
bibliografia
-Harry Mileaf. (1985). ELECTRICIDAD 1-7. Mexico, Colombia,España,Argentina,Puerto Rico : LIMOSA S.A
-Electricidad principios y aplicaciones. (2019). Retrieved 18 November 2019, from https://books.google.com.mx/books?
-YouTube. (2019). Retrieved 18 November 2019, from https://www.youtube.com/watch?v=4w5yGyWxnRo
-(2019). Retrieved 18 November 2019, from https://repositorio.uam.es/bitstream/handle/10486/680430/EM_12_3.pdf?sequence=1









Comentarios
Publicar un comentario